Contenidos
¿Qué son las técnicas colorimétricas?
8.2.5. Determinación de la colorimetría con las 3 muestras de agua residual doméstica
8.2.5.1. Análisis cuantitativo por colorimetría
8.2.5.1.1. Introducción de la prueba
Las técnicas colorimétricas se basan en la medida de la absorción de radiación en la zona visible por sustancias coloreadas. En algunas ocasiones, la muestra que deseamos determinar no posee color por sí misma; en tal caso, es preciso llevar a cabo un desarrollo de color empleando reactivos que den lugar a sustancias coloreadas con la muestra que interesa estudiar.
La colorimetría y fotocolorimetría no son en realidad técnicas distintas y la diferencia estriba en el tipo de instrumental empleado, de forma que se denomina colorímetro a aquellos aparatos en los que la longitud de onda con la que vamos a trabajar se selecciona por medio de filtros ópticos; en los fotocolorímetros o espectrofotómetros la longitud de onda se selecciona mediante dispositivos mono-cromadores.
8.2.5.1.1.1. Objetivos específicos:
Comparar los valores de la absorción de luz de las substancias objeto de estudio.
8.2.5.1.2. Fundamento teórico:
Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría de absorción, como la medida de la atenuación que el material a estudiar (muestra) efectúa sobre una radiación incidente sobre el mismo con un espectro definido. En general, las medidas se realizan dentro del espectro comprendido entre 220 y 800 nm, y este espectro, a su vez, puede dividirse en dos amplias zonas: la zona de la radiación visible, situada por encima de 380 nm, y la zona de la radiación ultravioleta situada por debajo de estos 380 nm. La región del infrarrojo se sitúa por encima de los 800 nm.
En el proceso de absorción de la radiación, un fotón incidente transmite su energía a una molécula (llamada absorbente) lo que da lugar a su excitación pasando a un nivel de energía superior. Este proceso se representa de la siguiente forma:
A + h ![]() A*
A* ![]() A + calor en la que A es el absorbente en su estado de energía bajo, A* en su nuevo estado de excitación energética y ην (h es la constante de Planck y ν la frecuencia) es la energía del fotón incidente, el cual posee una longitud de onda λ (λ*ν = c, donde c es la velocidad de la luz). A* es ordinariamente inestable y rápidamente revierte a su estado energético más bajo, perdiendo así la energía térmica correspondiente. Sólo se absorben determinadas frecuencias luminosas, y la selección de las mismas depende de la estructura de la molécula absorbente.
A + calor en la que A es el absorbente en su estado de energía bajo, A* en su nuevo estado de excitación energética y ην (h es la constante de Planck y ν la frecuencia) es la energía del fotón incidente, el cual posee una longitud de onda λ (λ*ν = c, donde c es la velocidad de la luz). A* es ordinariamente inestable y rápidamente revierte a su estado energético más bajo, perdiendo así la energía térmica correspondiente. Sólo se absorben determinadas frecuencias luminosas, y la selección de las mismas depende de la estructura de la molécula absorbente.
8.2.5.1.3. Leyes de la absorción de energía radiante:
Se refieren a las relaciones existentes entre la cantidad de absorbente y el grado con el que es absorbida la energía radiante. En términos generales, puede decirse que hay dos variables capaces de afectar al grado de absorción: la concentración del absorbente y la longitud del trayecto que el rayo luminoso recorre a través de la solución. La relación entre ambas se expresa con la fórmula denominada Ley de Beer:
P = Po 10-abc
P = potencia radiante transmitida
Po = potencia radiante incidente una cantidad proporcional a la misma, medida colocando en la cubeta el solvente puro.
a = absortividad, constante característica del absorbente y de la longitud de onda de la radiación incidente.
b = longitud del paso de la luz a través de la solución del absorbente, expresada generalmente en cm.
c = concentración del absorbente
Algunos autores prefieren utilizar términos de Io e I, expresando entonces intensidad en lugar de potencia.
En la práctica lo que tiene importancia es la proporción P / Po denominada transmitancia (T) o cuando se multiplica por 100, porcentaje de transmitancia (%T). La ley de Beer también puede escribirse de la siguiente forma log (Po / P) = abc
El término log (Po / P) se define como la Absorbancia. Cuando las medidas se efectúan utilizando siempre la misma cubeta (o bien un grupo de cubetas estandarizadas que posean un paso de luz constante) y los efectos ópticos debidos a la cubeta son reproducibles, el término b de la expresión de la absorbancia se hace constante. Dado que a es también constante para un determinado absorbente y una concreta longitud de onda, resulta entonces que la absorbancia es directamente proporcional a la concentración: A = kc (k = ab).
La ventaja fundamental que ofrece el empleo de la Absorbancia en lugar de la Transmitancia es que la relación existente entre la concentración y la absorbancia es lineal, cosa que no sucede con el %T.
Dado que la Absorbancia es proporcional a la concentración, tendremos que:
A1 / A2 = C1/ C2 donde,
A1 = Absorbancia del problema
A2 = Absorbancia de un estándar de concentración conocida
C1 = Concentración del problema
C2 = Concentración del estándar
Concentración (problema) = A1 (problema) / A2 (estándar)* Concentración estándar
Observación:
– Esta prueba se hizo en laboratorio de química y bioquímica (Ciencias Básicas II) con la colaboración del técnico de laboratorio David Pacheco de la Universidad Simón Bolívar.
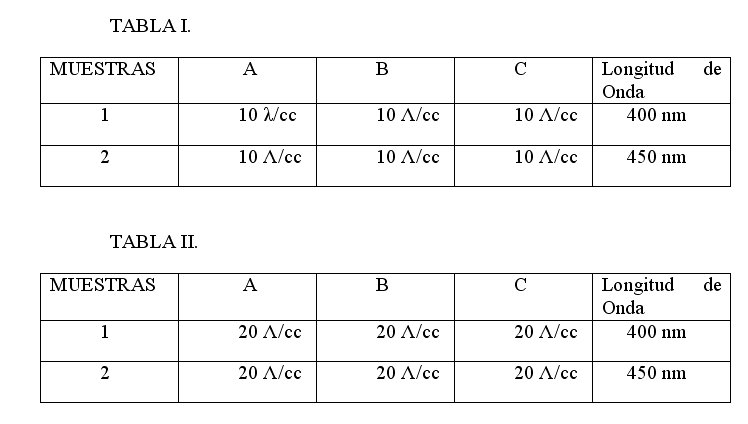
– Como se desconocía el patrón a seguir en cada muestra, en cuanto a la intensidad de luz, se utilizaron 2 longitudes de onda diferentes (400 nm- 450 nm) y también 2 volúmenes diferentes de cada muestra (10 λ = 0.01 cc – 20 λ = 0.02 cc).
– Muestra de agua residual doméstica A = Jaboncillo
– Muestra de agua residual doméstica B = Dte. Biodegradable
– Muestra de agua residual doméstica C = Dte. Convencional
– La absorbancia es inversamente proporcional a la transmitancia.
– Al momento de hacer la filtración de las muestras a cada erlenmeyer pudo haber quedado el principio activo de cada detergente en el fondo, de manera desproporcional, lo que altera un poco los resultados.

Prueba de Absorbancia/Transmitancia II Fase.
8.2.5.1.4. Materiales:
-12 tubos de ensayo
– Fotocolorímetro
– 2 pipetas automáticas de Vol. Variable (0-100 / 100-1000)
– 3 erlenmeyer
– 3 embudos de separación
– 3 papel filtro
– Agua destilada
8.2.5.1.5. Procedimiento:
1. Si filtraron todas las muestras con papel filtro y embudos a erlenmeyer, ya que los sólidos suspendidos de la materia orgánica podían interferir en la prueba.
2. Se depositaron con una pipeta automática a cada tubo de ensayo los volúmenes respectivos de cada muestra y luego se diluyeron en 1 cc de agua destilada.
3. Se depositó el contenido de cada tubo de ensayo en otro más pequeño y rectangular para colocarlo en el colorímetro con sus respectivas longitudes de onda y la máquina nos daba los valores de absorción inmediatamente.
Nm = nanómetro (Unidad de Longitud / intensidad de luz – rango visual)
– Λ/λ = lambda (Longitud de Onda / Velocidad – Frecuencia)
Cc = cm3 (Unidad de Volumen)
– 1000 λ = 1cc.:. 10 Λ = 0.01 cc 20 Λ = 0.02 cc
![]() Más información sobre detergente biodegradable.
Más información sobre detergente biodegradable.
19 marzo, 2019








